طراحی و ساخت باتری های فلز هوا به عنوان سیستم های جدید ذخیره کننده انرژی
باتری های آلومینیوم- هوا ، منیزیم- هوا، لیتیم-هوا و... در دسته ی باتری های سیستم فلز – هوا می باشند.این باتری ها دارای چگالی انرژی نظری و ولتاژ کاری بالا هستند. با این حال مقادیر قابل دستیابی عملی آنها به علت واکنش خوردگی پارازیتی با تولید هیدروژن، بسیار پایین است. علاوه بر این، این باتری ها به صورت الکتریکی قابل شارژ نیستند، زیرا ترسیب الکتریکی آلومینیوم و منیزیم از لحاظ ترمودینامیکی در الکترولیت های آبی امکانپذیر نمیباشد. باتریهای آهن- هوا میتوانند به صورت الکتریکی شارژ شوند و دارای عمر چرخهای طولانی (چرخه 1000>) هستند، با این حال چگالی انرژی آنها در مقایسه با سایر باتریهای هوا- فلز مقدار پایینتری دارد. بنابر دلایل ذکر شده عمده ی باتری های فلز-هوا قابلیت تجاری سازی و تولید در مقیاس صنعتی را دارا نمی باشند.
باتری های روی-هوا به دلیل پایداری نسبتا بالا و برگشت پذیری روی(زینک) به ویژه در الکترولیت های قلیایی، قیمت پایین و ایمنی بالا نسبت به سایر باتری های فلز-هوا صاحب تکنولوژی ویژه می باشند.تجاری سازی باتری های روی-هوا اولیه در سال 1932 آغاز شده است و تنها در سمعک ها، ساعت ها،چراغ های ناوبری و سیستم های سیگنال راه آهن استفاده می-شود.با این حال مشکلات مربوط به حفظ ظرفیت و عمر چرخه، که به طور عمده به تشکیل دندریت روی، تغییر شکل در حین بازسازی روی و عملکرد نامطلوب الکترود هوا وابسته است، تجاری سازی باتری های ثانویه (قابل شارژ) را کاهش داده است.اخیرا با توجه به پیشرفت های حاصل شده بیش از 5 شرکت آمریکایی و چندین شرکت اروپایی موفق به توسعه و ساخت باتری های روی-هوا قابل شارژ در چرخه ی عمر بالا شده اند.
تعداد زیادی از باتریهای فلز هوا در مرحله تحقیقات هستند. باتریهای -یون لیتیم که از جمله پرمصرف ترین باتریهای متداول هستند که اتومبیلهای برقی مورد استفاده قرار میگیرند . پیشبینی میشود از این باتری ها تا سال 2027 استفاده شود. توسعهی فناوریهای جدید مربوط به باتری ها به گونهای است که بتوان از آن ها در تجهیزات موتورهای با احتراق داخلی متداول نیز استفاده نمود. باتری های لیتیم – هوا ، لیتیم – سولفور ، روی – هوا و باتری های منیزیومی از جمله فناوریهایی هستند که در مرحله تحقیقات به سر میبرند و تحقیقات گسترده ای برای افزایش راندمان آن در حال انجام است. این قبیل فناوریها در مرحله کاربرد حقیقی مسائل و مشکلاتی را نیز به همراه خواهند داشت. این دسته از باتریها به عنوان ذخیره کنندههای انرژی در سطح بینالمللی مطرح بوده ولی بصورت انحصاری در حیطه معدود کشورهای جهان (آمریکا، اسپانیا، ....) مورد بهرهبرداری قرار گرفته است و محدودیتهایی جدی در صادرات آنها به کشورهای دیگر اعمال میگردد. طرح پژوهشی حاضر برای اولین بار در سطح کشور با رویکرد بومی سازی دانش فنی و تولید صنعتی باتری های روی(زینک)-هوا اجرا خواهد شد که سابقهی تولید آن در ایران وجود ندارد. محصول مورد نظر دارای مشابه خارجی است ولی تا به حال نمونه ای از آن در اشل صنعتی وارد کشور نشده است و این واحد برای نخستین بار اقدام به طراحی و تولید نمونه صنعتی آن میکند.
ویژگی های عمومی
باتری های زینک -ایر، بر اساس مواد فعال روی(زینک) ، ولتاژ سلولی تئوری برابر با V 1/65 و چگالی انرژی بالا و قابل قبول در حدود Wh / kg 1350 دارند. با این حال، اثرات قطبی شدن که به طور عمده از فعالسازی ، افت اهمی و از دست دادن غلظت یک الکترود هوا ناشی میشود، ولتاژ و عملکرد باتری را تحت شرایط عملی کاهش میدهد. به عنوان مثال، ولتاژ تخلیه یک سلول روی-هوا معمولاً از 1 تا 3/1 ولت است، در حالی که ولتاژ شارژ تقریبا 8/1 ولت یا بالاتر میباشد. اختلاف پتانسیل بالای این باتری ها در طول فرآیند شارژ- تخلیه منجر به از دست دادن کل بهرهوری انرژی و عملکرد آنها حتی قبل از اینکه هر گونه عوامل دیگر در نظر گرفته شود، میگردد. در طی تخلیه، باتری های زینک-ایر از طریق اتصال الکتروشیمیایی یک آند روی(زینک) به کاتد هوا در حضور یک الکترولیت قلیایی با یک واکنشگرکاتدی پایانناپذیر (اکسیژن) از اتمسفر به عنوان منبع تولید برق عمل میکند. الکترون هایی که در آند (روی) آزاد میشوند، از طریق بار خارجی به سمت کاتد (هوا) حرکت میکنند و تولید یون روی(زینک ) رخ می دهد. در همین زمان، اکسیژن اتمسفر به الکترود متخلخل هوا نفوذ میکند و آماده است تا از طریق واکنش ORR (واکنش مستقیم 1-1) به یونهای هیدروکسید احیاء شود که یک واکنش سه فازی، در ارتباط بین اکسیژن (گاز)، الکترولیتها (مایع) و الکتروکاتالیستها (جامد) می باشد. سپس یونهای هیدروکسید تولیدشده از محل واکنش به الکترودهای روی مهاجرت میکنند و تشکیل یون های زینکات میدهند (واکنش مستقیم 1-2)، سپس در غلظت فوق اشباع از زینکات بیشتر به اکسید روی (ZnO) نامحلول (واکنش مستقیم 1-3) تجزیه میشود. معادله 1-4 واکنش کلی آند را نشان میدهد. در طول شارژ، باتری های زینک-ایر ها قادر به ذخیره انرژی الکتریکی از طریق واکنش ردوکس معکوس در واکنش تولید اکسیژن (OER) بین الکترود و الکترولیت (واکنش برگشت 1-1) هستند، درحالیکه روی(زینک) درسطح کاتد ترسیب میشود (واکنش برگشت 1-4). واکنش کلی شارژ و تخلیه در یک الکترولیت قلیایی مطابق زیر میباشد:
واکنش الکترود هوا:
O2 + 2H2O + 4e- =4OH- , E= -0/40V vs. SHE (1-1)
واکنش الکترود روی:
Zn + 4OH- = Zn (OH)42- +2e- , E= +1/25 V vs. SHE (2-1)
Zn (OH)4-2 = ZnO +2OH- + H2O (3-1)
Zn + 2OH- = ZnO + H2O + 2e-, E = +1/25 V vs. SHE (4-1)
2Zn + O2 = 2ZnO, E = 1/65 V vs.SHE (واکنش کلی)
شماتیکی از یک باتری زینک- ایر قابل شارژ و تصویری از اجزای سازنده آندر شکلهای 1-1 و 1-2 به ترتیب نشان داده شده است.فلز روی (زینک) به صورت ترمودینامیکی در یک الکترولیت آبی ناپایداراست، زیرا پتانسیل احیاء آن به مراتب پائینتر از الکترودهای هیدروژن است.
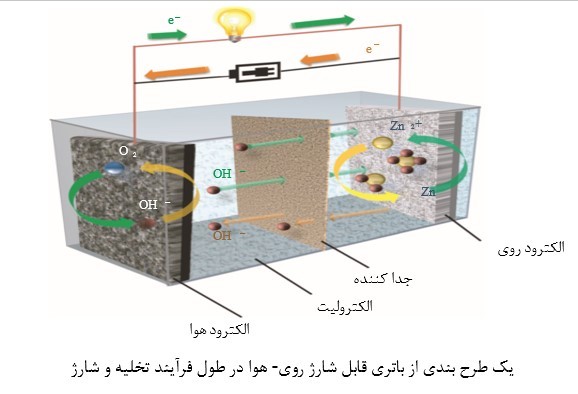
بنابراین همواره یک نیروی محرکه که سبب خوردگی و یا اکسیداسیون روی(زینک) همراه با تولید هیدروژن هست، وجود دارد. همانطور که توسط واکنش زیر بیان شده است و در اصطلاح فنی تخلیهی خود به خودی باتری نامیده میشود.
(1-6) (خود تخلیه) Zn + 2H2O = ZnO + H2

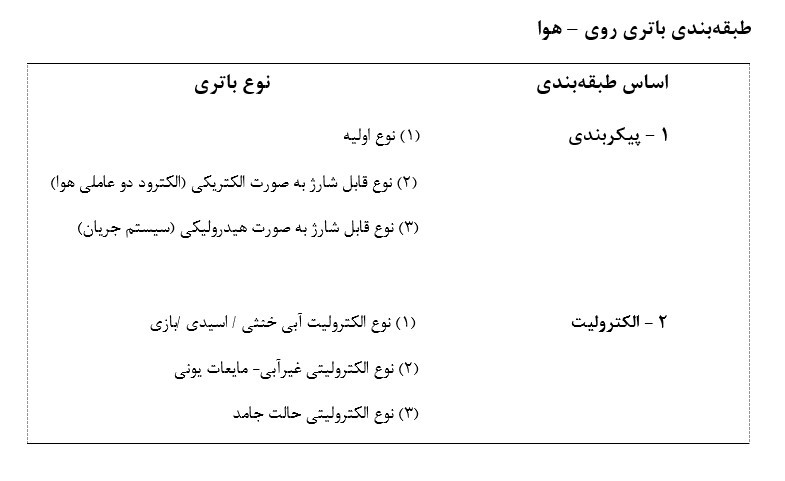
باتری های زینک - ایر میتوانند بسته به پیکربندی، الکترولیتها و الکترودها به انواع مختلفی طبقهبندی شوند که در جدول زیر قابل مشاهده است. طرحهای قابل شارژ مکانیکی از مبادله الکترود روی (زینک) "تازه" و سوخت گیری از شلاب روی (زینک) تازه / الکترولیت در طول حالت شارژ، استفاده میکنند، در حالیکه شارژ الکتریکی باتری به یک الکترود جداگانه سوم (جهت حفظ OER برای شارژ) یا یک الکترود دو عاملی (الکترودی که قادر به انجام هر دو ORR و OER باشد ) نیاز دارد تا بتوان باتری را شارژ کرد.
ولتاژ پایانی اندازهگیری شده برای باتری در هر حالت خاص از تخلیه بسته به سرعت جریان بار، ساختار بلوری اجزای الکترود، امپدانس درونی داخل باتری و وضعیت شارژ ظاهر می شود. هر یک از سیستم باتری ها دارای ولتاژ واقعی و منحنی تخلیهی مشخص خود است. برای مثال، باتریهای مشخصی مانند باتریهای سرب- اسید دارای شیب تخلیه مشخصی هستند در حالی که باتریهای دیگر مانند باتریهای لیتیوم-یونی و باتریهای نیکل-کادمیم با نزول ناگهانی ولتاژ در پایان تخلیه، پروفیل های تخلیهی نسبتاً ثابتی دارند. ویژگی تخلیه شیبدار باعث میشود توان و خروجی انرژی به طور مداوم در طول چرخه تخلیه کاهش یابد و به همین ترتیب مشکلات را برای برخی از برنامههای کاربردی که نیاز به عرضهی خروجی پایدار دارند، افزایش میدهد.لذا منحنی تخلیه هموار به دلیل حداکثر انرژی خروجی، به طور کلی ترجیح داده می شود. به طور معمول، یک ولتاژ خروجی هموار در طول چرخه تخلیه را در جریان ثابت حفظ میکنند.












